
Przyszłym rodzicom często towarzyszy lęk o zdrowie ich planowanego potomstwa. Wychodząc naprzeciw oczekiwaniom par planującym powiększenie rodziny CGM Genesis oferuje test STID (ang. Screening Test for Inherited Disorders), który jest przesiewowym testem na nosicielstwo ponad 500 najczęstszych chorób genetycznych dziedziczonych w sposób autosomalny recesywny. Wykonanie testu u przyszłych rodziców pozwoli na określenie, czy mają oni podwyższone ryzyko wystąpienia choroby u ich potomstwa, ponieważ jeżeli oboje rodzice są nosicielami patogennego wariantu genetycznego w tym samym genie, wówczas mają 25% ryzyka, że ich dziecko będzie dotknięte chorobą recesywną. W takim przypadku można potwierdzić lub wykluczyć obecność patogennego wariantu u dziecka w ramach badania prenatalnego – biopsji kosmówki (CVS) lub amniopunkcji (AC).

Całkowita częstość chorób recesywnych wynosi 1% i jest ona wyższa od częstości występowania zespołu Downa. Jeżeli test STID wykaże, że żaden z partnerów nie jest nosicielem określonej choroby, wówczas ryzyko urodzenia dziecka z taką chorobą jest zazwyczaj niższe niż 1 na milion. Test oferujemy każdej parze planującej ciążę. Dla partnerów spokrewnionych planujących założenie rodziny test ten jest szczególnie ważny - im bliższy stopień pokrewieństwa między partnerami, tym większa pula wspólnych genów, a tym samym większe ryzyko nosicielstwa mutacji w tych samych genach.
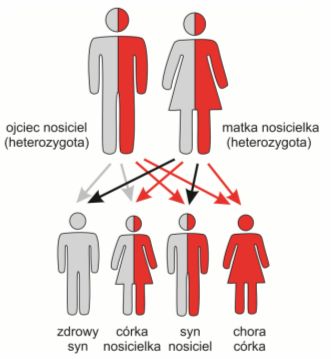
Każdy z nas jest nosicielem mutacji w pojedynczej kopii genów odpowiedzialnych za choroby dziedziczone w sposób autosomalnie recesywny (każde białko organizmu jest kodowane przez 2 kopie danego genu, z których jedna jest od matki, druga od ojca). Takie nosicielstwo mutacji nie wiąże się jednak z objawami choroby, ponieważ aby choroba dziedziczona w sposób autosomalny recesywny mogła się ujawnić, mutacja musi dotyczyć obu kopii danego genu. Badania przeprowadzone w ostatnich latach wskazują, że każdy zdrowy człowiek jest nosicielem ok. 10 wariantów recesywnych dla chorób genetycznych. Istotne jest aby para planująca ciążę miała świadomość, czy oboje partnerzy nie są nosicielami uszkodzeń w tych samych genach, co wiązałoby się z wysokim ryzykiem wystąpienia choroby genetycznej u ich przyszłego potomstwa.
UWAGA: Ponieważ u każdej zdrowej osoby w teście STID identyfikowane są średnio 2-3 mutacje w różnych genach, badanie oferujemy WYŁĄCZNIE PAROM planującym ciążę. Nieuzasadnione jest wykonywanie testu u pojedynczej osoby lub jednej osoby w parze, gdyż dopiero zestawienie mutacji wykrywanych u obojga partnerów daje informację o ewentualnym podwyższonym ryzyku choroby recesywnej u przyszłego dziecka. W związku z powyższym faktem, nasze laboratorium przyjmuje do badań wyłącznie materiał pobrany jednoczasowo od OBOJGA PARTNERÓW. Nie wykonujemy niniejszego badania w przypadku próbki pobieranej od jednej osoby w parze.
Test STID umożliwia analizę genów związanych z ponad 500 najczęstszymi chorobami recesywnymi, włącznie z mukowiscydozą, rdzeniowym zanikiem mięśni, niepełnosprawnością intelektualną, niedosłuchem, ślepotą/niedowidzeniem i wieloma innymi ciężkimi chorobami genetycznymi, dotykającymi dzieci - (lista wszystkich badanych chorób i genów).
MATERIAŁ DO BADANIA: Test STID wykonywany jest z wymazu z jamy ustnej pobranego na dedykowany zestaw pobraniowy.
METODYKA: DNA analizowany jest metodą sekwencjonowania następnej generacji (NGS) oraz poddawany jest analizie w kierunku delecji-duplikacji dla ponad 500 najczęstszych chorób o uwarunkowaniu recesywnym.
CZAS REALIZACJI: Rutynowy czas oczekiwania na wyniki testu STID wynosi 1,5 miesiąca od momentu dostarczenia próbki do laboratorium. W przypadku ciąży czas oczekiwania może zostać skrócony do 1 miesiąca.
WSKAZANIE DO WYKONANIA BADANIA: Test STID może zostać wykonany przez każdą parę planującą ciążę lub spodziewającą się dziecka, bez specjalnych wskazań, ponieważ choroby recesywne dotykają potomstwa osób pozbawionych objawów, nieświadomych nosicielstwa patogennego wariantu w tym samym genie.
OGRANICZENIA METODY: Badane próbki analizowane są wyłącznie pod kątem mutacji odpowiedzialnych za wymienione w tabeli 500 najczęstszych chorób genetycznych o dziedziczeniu recesywnym. Mutacje odpowiedzialne za inne choroby lub mutacje w genach niewymienionych w tabeli nie są identyfikowane. Ze względu na opisane ograniczenia, prawidłowy wynik testu STID nie wyklucza nosicielstwa innych chorób genetycznych.
WYNIK BADANIA: Wyniki testu STID zostaną przesłane pacjentom lub lekarzowi kierującemu. Konsultacja genetyczna w celu omówienia wyników testu STID lub dalsza diagnostyka zgodna ze wskazaniami lekarza genetyka możliwa jest w CGM Genesis.
NIEZBĘDNE DRUKI I INFORMACJE DLA PACJENTA:
FORMULARZ ZGŁOSZENIA: Pobierz
INFORMACJA O TRANSPORCIE: Pobierz
BROSZURA INFORMACYJNA: Pobierz
INSTRUKCJA POBRANIA PRÓBKI: Pobierz







